日本結晶学会誌 Vol.64 4号(表紙)
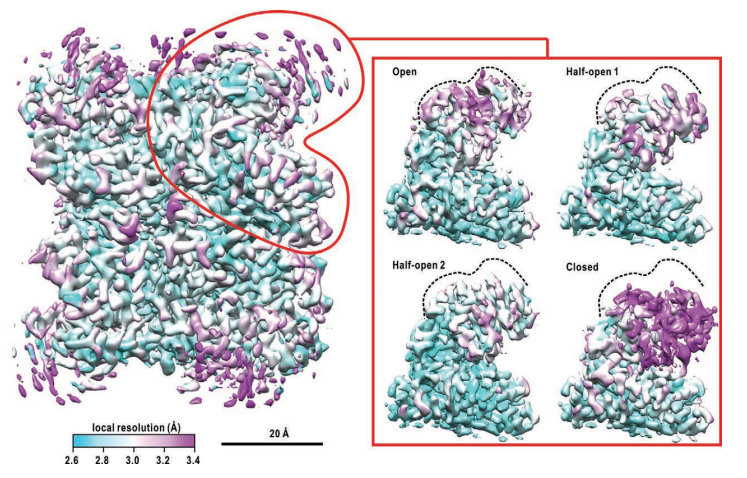
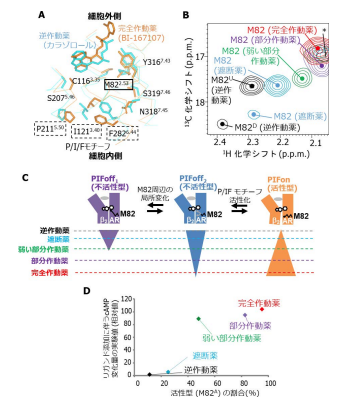
クライオ電子顕微鏡で可視化された超高度好熱菌由来グルタミン酸脱水素酵素の溶液中ドメイン運動における準安定状態 クライオ電子顕微鏡(cryo-EM)では急速凍結した生体高分子溶液を80 K程度の低温化で観察する. 急速凍結によって生体高分子は非晶質氷に包埋されるので,溶液中での構造を保った観察が可能となる. さらに,観察される各分子の構造は氷包埋固定によって構造揺らぎ中の準安定構造へトラップされるため, 構造多形を仮定しながら多数の観察像を解析することで,溶液中での生体高分子動態について情報を得ることができる. 左図はcryo-EMによって得られた超高度好熱菌由来グルタミン酸脱水素酵素(GDH)の静電ポテンシャルマップである. GDHはホモ六量体タンパク質であり,各サブユニットは分子中心で六量体を形成するcoreドメインと補酵素ヌクレオチドを結合するNADドメインで構成されている. 六量体に内在するサブユニットの対象性を仮定して得たマップでは,GDHの構造揺らぎを反映して,NADドメイン像の詳細に乏しいものであった. さらにNADドメイン部分に着目して三次元構造分類を行ったところ,右図のようにドメイン間に形成される活性クレフトの開閉度合いが異なる4つの準安定構造が得られた. GDHのクレフト開閉運動は結晶構造からも示唆されていたが,cryo-EMによる溶液中構造の可視化から, 結晶環境下では観察できなかったNADドメインの剪断運動で生じる準安定構造の存在が明らかとなった(John Wiley and Sonsより改変後の転載許諾済).